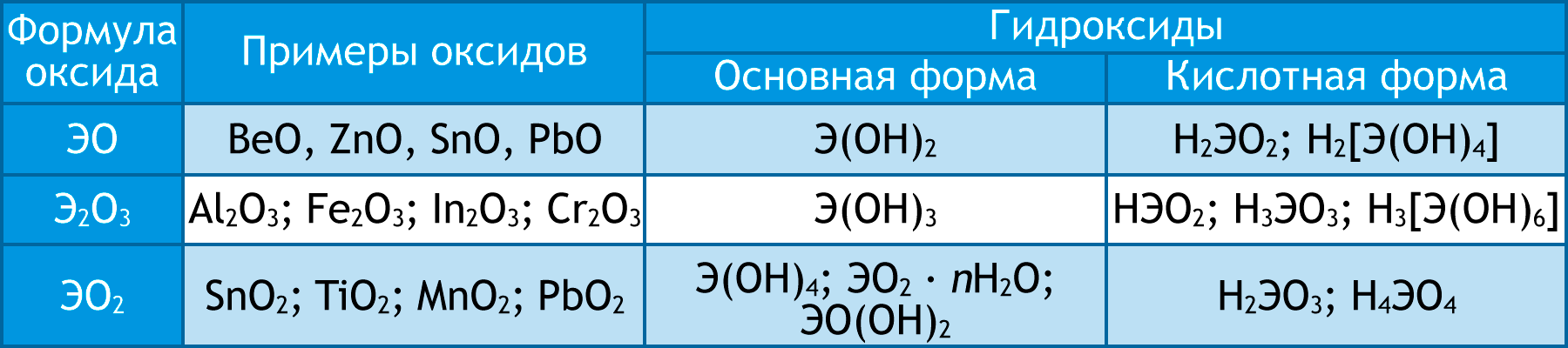
- Амфотерные соединения обладают свойствами как кислоты, так и основания.
- Среди неорганических соединений амфотерные свойства проявляют оксиды и гидроксиды некоторых металлов в степени окисления +2 (Be, Zn, Sn, Pb), а также оксиды и гидроксиды, в которых металлы имеют степень окисления +3 и +4:
ZnO + H2SO4 = ZnSO4 + H2O и ZnO + 2NaOH + H2O = Na2[Zn(OH)4];
Al(OH)3 + 3HCl = AlCl3 + 3H2O и Al(OH)3 + 3NaOH = Na3[Al(OH)6].
- Амфотерным соединением является вода H2O:
H2O + HCl = H3O⁺ + Cl⁻и H2O + NH3 = NH4⁺ + OH⁻.
- Типичными примерами амфотерных органических соединений являются аминокислоты, содержащие основную аминогруппу и кислотную карбоксильную группу, например, аминоуксусная кислота NH2–CH2–COOH:
NH2–R–COOH + HCl = [NH3–R–COOH]⁺Cl⁻;
NH2–R–COOH + NaOH = NH2–R–COONa + H2O.
- Аминокислоты могут реагировать друг с другом, образуя полипептиды и белки:
NH2–R–COOH + NH2–R–COOH = NH2–R–CO–NH–R–COOH + H2O;
пNH2–R–COOH = (–NH–R–CO–)п + (п − 1)Н2О.
Неорганические амфотерные оксиды и гидроксиды