- Электролиз – окислительно-восстановительная реакция в растворе или расплаве электролита под действием постоянного электрического тока.
- Катод – отрицательно заряженный электрод, на нём идёт восстановление, Анод – положительно заряженный электрод, на нём происходит окисление.
Под действием постоянного электрического тока в расплаве электролита на катоде восстанавливаются катионы металла: K: Na⁺ + → Na0; , на аноде окисляются анионы кислотного остатка: A: 2Cl⁻ − 2 → Cl20; 2NaCl 2Na0 + Cl20.
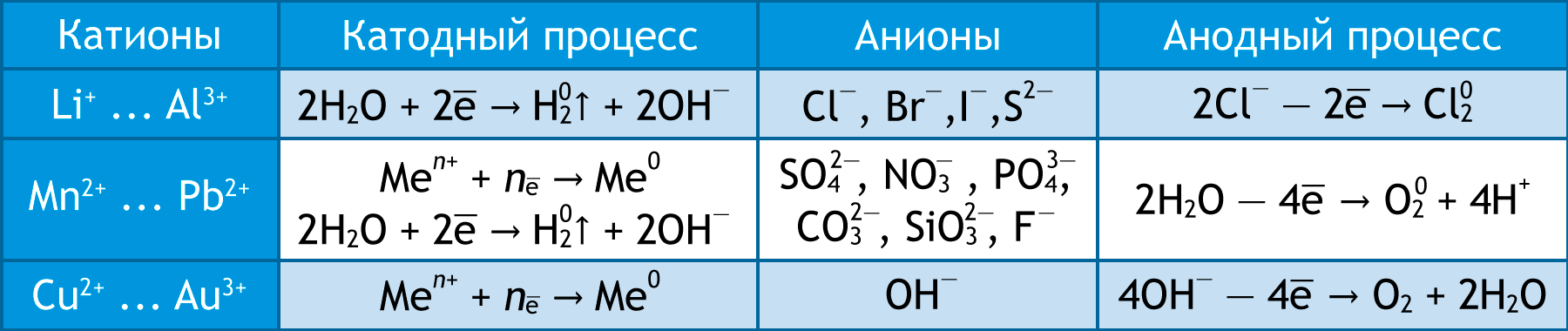
В водном растворе катионы малоактивных металлов (Cu2⁺ … Au3⁺) всегда восстанавливаются на катоде: K: Cu2⁺ + 2 → Cu0. Катионы активных металлов (Li⁺ … Al3⁺) из водных растворов не восстанавливаются, на катоде восстанавливаются молекулы воды: K: 2Н2О + 2 → Н20 + 2ОН⁻. Катионы металлов средней активности (Mn2⁺ … Pb2⁺) восстанавливаются одновременно с молекулами воды.
Если анод изготовлен из металла (кроме Au и Pt), происходит окисление анода: Cu0 − 2 → Cu2⁺. Если анод инертный (С, Au, Pt), окисляются бескислородные анионы (кроме F⁻): 2Cl⁻ − 2 → Cl20. Кислородсодержащие анионы (SO42⁻, NO3⁻) и F⁻ не окисляются. Происходит окисления молекул воды: A: 2Н2О − 4 → О2 + 4Н⁺.
- Электролизом получают особо чистые металлы, газы, наносят металлические покрытия, изготовляют точные копии поверхностей, очищают воду.
Катодные и анодные процессы при электролизе водных растворов