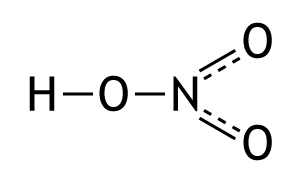
Строение молекулы азотной кислоты
- Азотная кислота HNO3 – бесцветная жидкость, хорошо растворима в воде, сильный электролит, сильный окислитель.
- В молекуле азотной кислоты атом азота соединён с одним атомом кислорода одинарной ковалентной полярной связью, а два других атома кислорода соединены с атомом азота полуторными связями. Валентность атома азота равна IV, а степень окисления – +5.
- Химические свойства азотной кислоты:
CaO + 2HNO3 = Ca(NO3)2 + H2O
NaOH + HNO3 = NaNO3 + H2O
Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
- Продукты реакции азотной кислоты с металлами зависят от их активности:
- с активными металлами:
8Al + 30HNO3(оч. разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
- с металлами средней активности:
4Zn + 10HNO3(разб) = 4Zn(NO3)2 + N2O + 5H2O
- с малоактивными металлами:
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO↑ + 4H2O
- Концентрированная азотная кислота пассивирует Al, Cr, Fe, с остальными металлами выделяется диоксид азота:
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O
- Получение 60%-ной азотной кислоты в промышленности:
4NH3 + 5O2 = 4NO + 6H2O (катализатор – Pt)
2NO + O2 = 2NO2; 4NO2 + 2H2O + О2 = 4HNO3