- Хлор – газ жёлто-зелёного цвета с удушающим запахом, ядовит, тяжелее воздуха, растворим в воде. Был получен и описан в 1774 шведским химиком Карлом Шееле. В природе встречается только в виде соединений – галита NaCl, сильвина KCl, сильвинита NaCl⋅KCl, бишофита MgCl2⋅6H2O, карналлита KCl⋅MgCl2⋅6H2O; в морской воде.
- В лаборатории хлор получают действием соляной кислоты HCl на MnO2 или KMnO4. Промышленный способ – электролиз растворов или расплавов хлоридов.
- Хлор применяют в неорганическом синтезе для получения соляной кислоты, хлорной извести, бертолетовой соли; в органическом синтезе как хлорирующий агент, в производстве полимеров и каучуков.
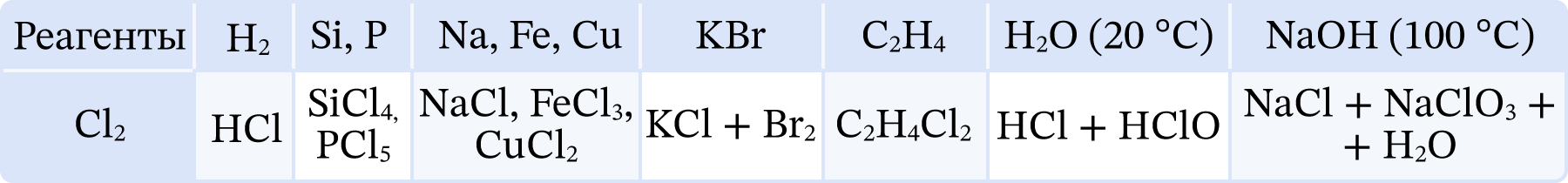
- Хлор с кислородом не взаимодействует. Под действием света смесь хлора с водородом взрывается в результате цепной реакции с образованием свободных радикалов. Хлор – сильный окислитель, взаимодействует с металлами и неметаллами, образуя хлориды в высшей степени окисления; вытесняет бром и йод из соответствующих солей; с углеводородами участвует в реакциях замещения и присоединения; в воде и водных растворах щелочей диспропорционирует.
Продукты взаимодействия