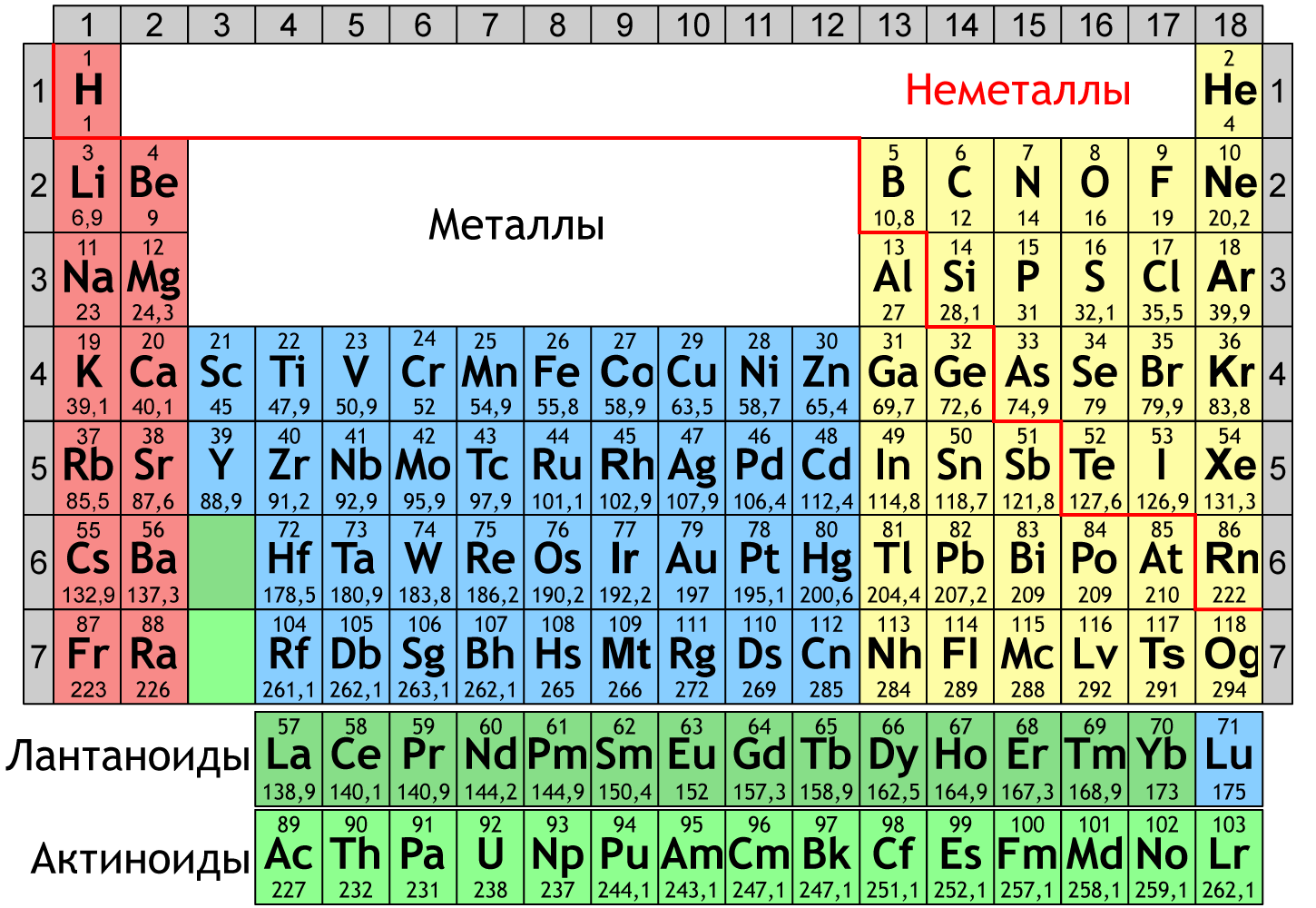
- В Периодической системе химических элементов металлы расположены ниже диагонали В–At в главных подгруппах, а также во всех побочных подгруппах.
На внешнем энергетическом уровне атомов металлов находится 1–3 электрона. Исключение составляют Ge, Sn, Pb (4), Sb и Bi (5) и Po (6).
- Все металлы – восстановители. В химических реакциях они легко отдают внешние электроны. Образуются катионы, внешняя оболочка которых подобна оболочке инертных газов. Это обеспечивает им устойчивость.
- Для металлов характерна низкая электроотрицательность.
- В периоде с увеличением заряда ядра атома металла электроотрицательность увеличивается, а металлические свойства уменьшаются.
- В группе с увеличением заряда ядра атома металла электроотрицательность уменьшается, а металлические свойства усиливаются.
- Для металлов характерна металлическая кристаллическая решётка, которая определяет физические свойства металлов: твёрдость, блеск, ковкость, тепло- и электропроводность.