Скорость химической реакции υ равна изменению числа молей вещества Δν в единице реакционного пространства в единицу времени Δt.
Гомогенная реакция идёт во всём объёме газовой или жидкой фазы, реакционным пространствоv является объём V. Число молей вещества в единице объёма – молярная концентрация Δc, поэтому скорость гомогенной реакции равна изменению молярной концентрации вещества Δc в единицу времени Δt.
Гетерогенная реакция идёт на границе раздела фаз, реакционным пространством является площадь границы раздела фаз S. Скорость гетерогенной реакции равна изменению числа молей вещества Δν на единицу площади границы раздела фаз S в единицу времени Δt.
Скорость реакции можно измерять как по изменению числа молей исходных веществ (в этом случае в формуле ставят знак «минус»), так и продуктов реакции (в этом случае в формуле ставят знак «плюс»).
Чтобы скорость реакции, выраженная через разные вещества, была одинаковой, выражения делят на стехиометрические коэффициенты.
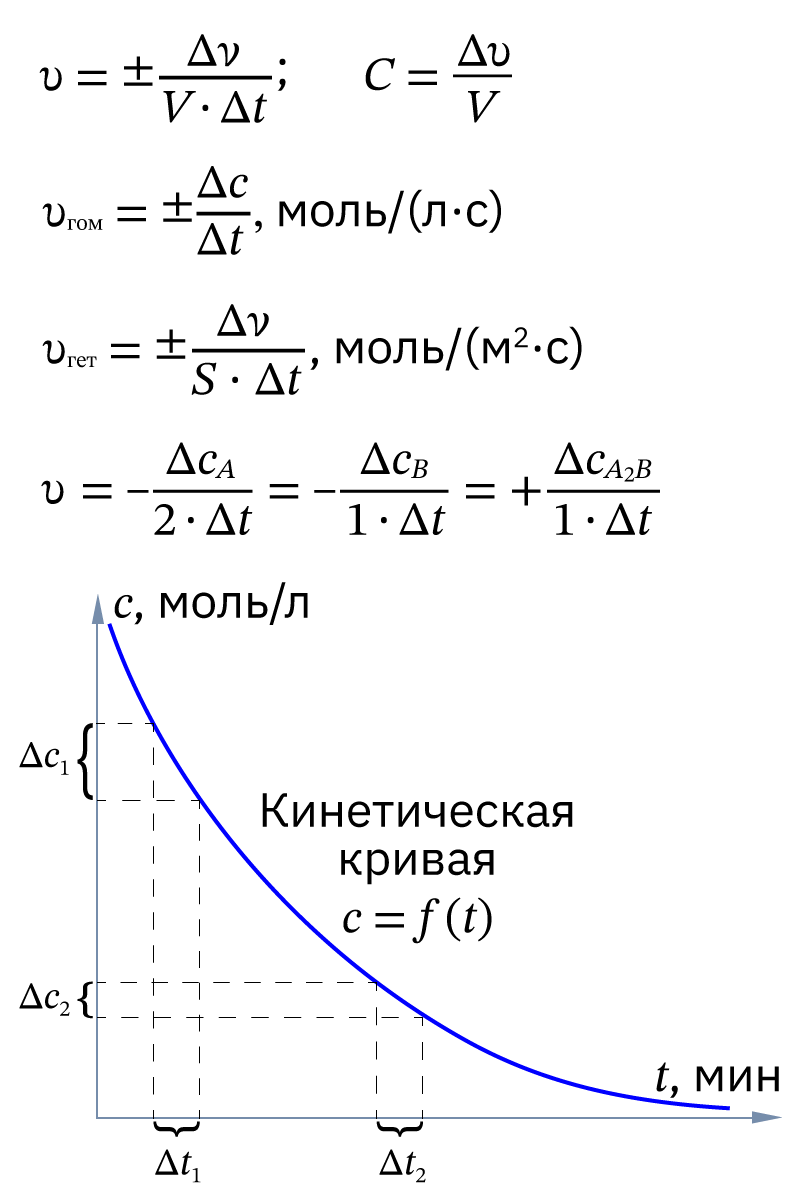
Кинетическая кривая – графической изображение изменения концентрации вещества в ходе реакции.