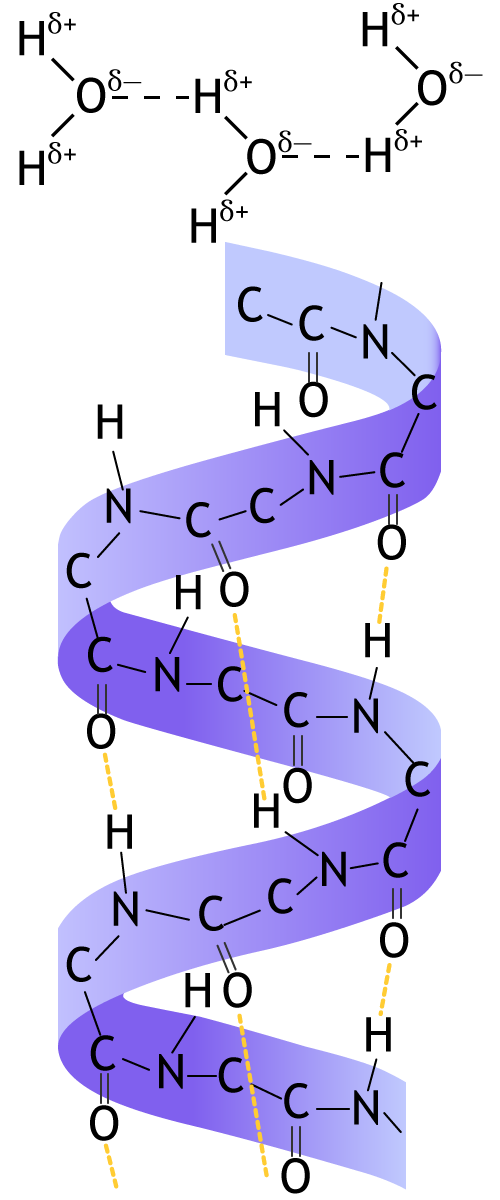
Химическая связь между атомом водорода одной молекулы (или её части) и атомом с высокой электроотрицательностью (F, O, N) другой молекулы (или её части) называется водородной связью.
Водородная связь образуется как за счёт электростатического притяжения положительно поляризованного атома водорода и атома с высокой электроотрицательностью, имеющего частично отрицательный заряд, так и за счёт донорно-акцепторного взаимодействия между почти свободной атомной орбиталью атома водорода и неподелённой парой электронов атомов F, O, N. Это определяет большую прочность водородной связи.
Водородная связь существует в жидком и твёрдом агрегатных состояниях вещества.
Водородная связь влияет на свойства веществ — возрастают вязкость, температуры плавления, кипения, поверхностное натяжение.
Водородная связь может быть меж- и внутримолекулярной (белки).
Виды
ван-дер-ваальсовых межмолекулярных взаимодействий:
ориентационное — между полярными молекулами;
индукционное — между полярной и неполярной молекулой;
дисперсионное — между двумя неполярными молекулами.