- Амины за счёт неподелённой пары электронов у атома азота проявляют основные свойства: R–CH2–NH2 + H2О → R–CH2–NH3⁺ + ОН⁻. Электронная плотность от углеводородного радикала смещается в сторону атома азота, в результате чего основные свойства алифатических аминов выражены сильнее, чем у аммиака.
СН3–CH2–NH2 + HCl → CH3–CH2–NH3⁺Cl⁻ (хлорид этиламмония).
Увеличение длины алифатического радикала приводит к ослаблению основных свойств аминов.
- Горение аминов:
4СН3–CH2–NH2 + 15О2 → 8СО2 + 14Н2О + 2N2.
- Нуклеофильное замещение:
С2H5–NH2 + С2H5–Br → (C2H5)2NH2⁺Br⁻.
- Образование амидов:
СН3СООСН3 + С2H5NH2 → СН3СО–NHСН2СН3 + СН3ОН;
СН3NH2 + C2H5COCl → C2H5–CO–NHCH3 + HCl.
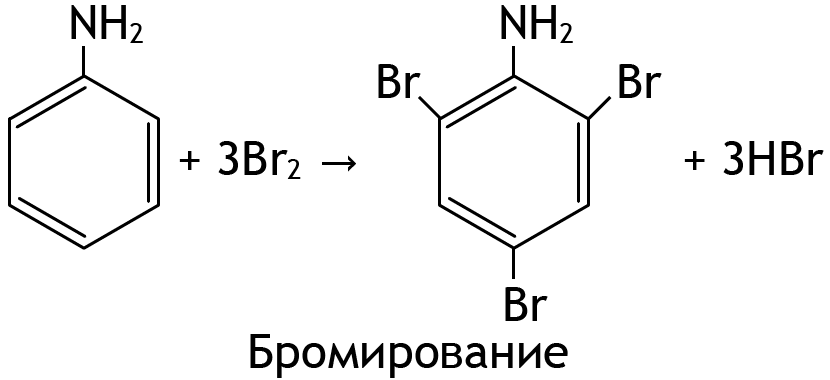
- Ароматические амины – более слабые основания по сравнению с алифатическими аминами и с аммиаком за счёт взаимодействия сопряжённой π-системы электронов бензольного кольца и неподелённой пары электронов атома азота.
- Аминогруппа – ориентант I рода, обладает отрицательным индуктивным и положительным мезомерным эффектом, поэтому бромирование и нитрование идёт в орто- и пара-положения.