- Для электрона, как для элементарной частицы, характерен корпускулярно-волновой дуализм: электрон одновременно обладает свойствами частицы (масса, заряд и импульс движения) и волны (дифракция и интерференция).
Луи де Бройль вывел зависимость длины волны λ движущейся частицы от импульса её движения: , где h – постоянная Планка, а p – импульс.
- Принцип неопределённости Гейзенберга: невозможно одновременно точно определить координаты элементарной частицы и импульс её движения.
- Электронная оболочка – совокупность всех электронов в атоме – состоит из электронных слоёв или энергетических уровней, образованных электронами, близкими по энергии. Число уровней равно номеру периода.
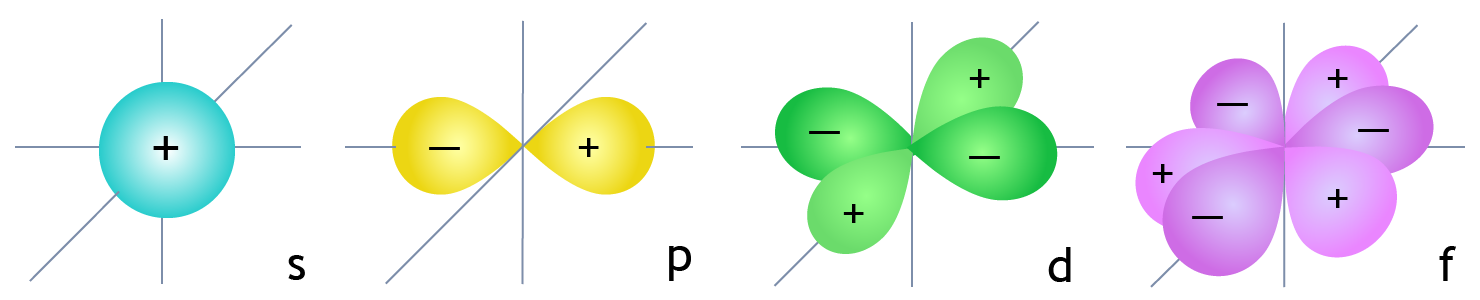
- Атомная орбиталь – пространство вокруг ядра атома, в котором наиболее вероятно нахождение электрона, – характеризуется квантовыми числами (кч).
- главное кч определяет запас энергии в атоме, n = 1, 2, …;
- орбитальное кч определяет форму орбитали: l(s) = 0, l(p) = 1, l(d) = 2, l(f) = 3;
- магнитное кч, определяет расположение орбитали в пространстве (–l …+l);
спиновое кч, определяет движение электрона на орбитали, равно .
- Каждый энергетический уровень состоит из подуровней, образованных атомными орбиталями одинаковой формы (s, p, d, f).