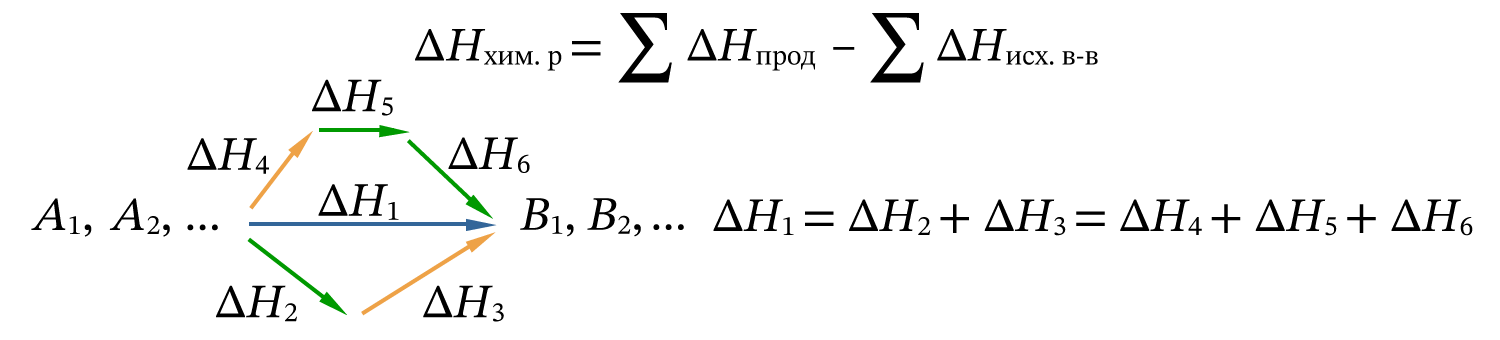Тепловой эффект (Q) – энергия, выделяемая или поглощаемая в ходе реакции, измеряется в кДж. Энтальпия (H) – характеристика изменения внутренней энергии системы в ходе реакции, при p = const и T = const ΔH = –Q.
Термохимическое уравнение – уравнение, в котором указан тепловой эффект.
Экзотермические реакции идут с выделением теплоты, Qэкз. р > 0.
Эндотермические реакции идут с поглощением теплоты, Qэнд. р < 0.
Теплота образования – тепловой эффект реакции образования 1 моль сложного вещества из простых веществ, измеряется в кДж/моль.
Теплота сгорания – тепловой эффект реакции сгорания 1 моль сложного вещества до углекислого газа и воды, измеряется в кДж/моль.
Закон Гесса: тепловой эффект реакции не зависит от пути протекания реакции, а только от состояния продуктов реакции и исходных веществ.
Тепловой эффект химической реакции равен сумме энергий образующихся связей минус сумма энергий разрываемых связей.
Следствие из закона Гесса: тепловой эффект химической реакции равен разности суммы теплоты образования продуктов реакции и суммы теплоты образования исходных веществ: